Жизнь в воде существенно отличается от жизни на суше. Так как вода обладает определенными лимитирующими экологическими факторами, с которыми живущие на суше организмы никогда не сталкиваются. Важнейшим из таких факторов является активная реакция воды, обозначаемая латинскими буквами pH (пэ-аш), происходящими от слов pondus Hydrogenii — вес водорода.
В морской воде этот показатель достаточно стабилен и находится в диапазоне 7,5-8,5, тогда как в пресной, может колебаться в достаточно широких пределах, в зависимости от сезона и даже времени суток.
Что же такое активная реакция воды?
Всем известна химическая формула воды — Н2О, ее молекула состоит из двух атомов водорода и одного атома кислорода. Под влиянием слабого электрического поля, часть молекул воды распадается на ионы, такой процесс называется диссоциацией.
На такие же ионы распадаются соли, кислоты и щелочи, растворенные в воде. Ионы воды обозначаются H+ (свободные водородные ионы) и ОН- (гидроксильная группа). Когда содержание и тех и других в воде равно, говорят, что вода имеет нейтральную реакцию. В такой воде диссоциирует одна молекула на каждые 10 000 000, а эту цифру можно выразить как десять в минус седьмой степени (и тех и других ионов соответственно будет 10-7 Н+ х 10-7 ОН- =10-14). В качестве показателя активной реакции воды берется десятичный логарифм показателя ионов с обратным знаком.
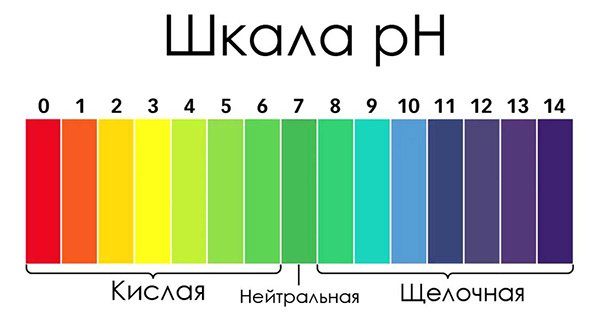
Нейтральному показателю будет соответствовать цифра 7, называемая водородным показателем и обозначаемая латинскими буквами рН.
Шкала показателей рН выглядит как прямая линия с делениями, от 0 до 14, где нейтральный показатель рН=7 находится строго посередине. Слева от него расположены кислые среды (слабокислая — кислая — сильнокислая соответсвенно), справа — щелочные (слабощелочная—щелочная—сильнощелочная).
Оптимальные условия для жизни подавляющего числа водных растений и животных складываются при значениях рН лежащих в диапазоне от 5 до 8 единиц, но это вовсе не означает, что в природе не существует гидробионтов способных жить и размножаться за пределами этого диапазона.
Отстоянная в течение нескольких суток водопроводная вода без каких-либо дополнительных добавок имеет активную реакцию, близкую к нейтральной.
Вследствие жизнедеятельности живых организмов в аквариуме, с течением времени, значение pH может меняться, делая воду более кислой или более щелочной.
Показатель рН в аквариуме крайне не стабилен, особенно в мягкой воде. Он зависит от многочисленных факторов, таких как: температура воды, жизнедеятельность растений, степень подвижности воды в водоеме. В аквариуме этот показатель постоянно меняется и судить о нем можно только приблизительно. В течение суток рН в аквариуме может колебаться на 2 единицы и более.
Проследим, как изменяется рН в аквариуме в течение суток.
В процессе дыхания гидробионтов поглощается кислород и выделяется углекислый газ. Образуется энергия, используемая для их жизнедеятельности. В химической формуле этот процесс будет выглядеть так:
С6Н12О6+ 6О2=6СО2+ 6Н2О+ химическая энергия.
Увеличение в воде концентрации углекислого газа вызывает ее подкисление. Отсюда следует, что все гидробионты своим дыханием способствуют снижению рН. Особенно явно это заметно ночью, когда растения перестают поглощать углекислоту. Днем, в процессе фотосинтеза, активность потребления углекислоты растениями заметно возрастает. В химической формуле это выглядит так:
6СО2+ 6Н2О+ солнечная энергия=С6Н12О6+ 602.
В результате образуются углеводы и свободный кислород. Поглощение СО2 растениями при хорошем освещении может идти столь активно, что поступление углекислоты, выдыхаемой другими обитателями аквариума, не может компенсировать потери, что вызывает повышение рН.

Значит, ночью рН в аквариуме изменяется в кислую сторону, а днем — в щелочную. Компенсировать такие сдвиги рН можно двумя способами:
1. Старую аквариумную воду опытные аквариумисты не меняют всю, а лишь регулярно подменивают определенную ее часть. Вода, доливаемая взамен испарившейся, препятствует колебаниям рН, но имеет постоянную тенденцию к снижению этого показателя. Там, где вода достаточно жесткая, этой проблемы практически не существует.
2. Круглосуточная аэрация воды: из пузырьков подаваемого в воду воздуха регулярно пополняется запас СО2 в воде.
Иногда аквариумисту требуется изменить показатель активней реакции воды. Для этого в воду добавляется кислота или щелочь. Далеко не все кислоты и щелочи подходят для этой цели, многие из них токсичны для живых организмов.
Изменить значение рН до необходимого уровня можно следующим образом: если рН выше необходимого значения, то воду можно подкислить, добавляя раствор пищевой лимонной кислоты; если ниже, то добавить раствор пищевой (питьевой) соды.
Для подкисления воды в аквариуме из неорганических кислот подходит только ортофосфорная кислота. Использование для этих целей соляной, серной или уксусной кислоты, как более распространенных, может вызвать нарушение обмена веществ у гидробионтов.
Ортофосфорную кислоту используют только в растворе и добавляют в аквариум каплями, при этом обязательно контролируя значение рН.
Более простой способ подкисления воды заключается в добавлении к ней экстракта торфа или отвара ольховых шишек. Столовая ложка ольховых шишек заливается стаканом кипятка и кипятится еще 5 – 7 минут. Стакан отвара рассчитан на 5 – 10 л воды.
К подкислению воды следует прибегать только в тех случаях, когда нужно создать вполне определенные условия для рыб.
При выращивании аквариумных растений такой необходимости обычно не возникает.
Со временем, в аквариумной воде накапливаются органические соединения, благодаря которым она приобретает кислую реакцию. Такая вода у аквариумистов называется старой.
Значительно чаще, чем подкислением, любителям аквариумных растений приходится заниматься подщелачиванием воды.
Для этой цели подходит любая щелочь. При использовании едкого натрия или едкого калия, которые следует применять только в растворе и пользоваться которыми необходимо с большой осторожностью, так как сдвиг рН в аквариуме в щелочную сторону происходит очень резко и сохраняется лишь в течение нескольких часов из-за активной жизнедеятельности водных организмов.
Самым надежным способом подщелачивания воды, гарантирующим стабильность показателей, следует считать добавление в воду питьевой соды в из расчета 0,2–0,5 грамм на 1 литр воды. Питьевая сода, она же гидрокарбонат натрия, имеет замечательные свойства. Эта соль ведет себя в растворе как слабая щелочь, но при этом с более сильными щелочами ведет себя как кислота.
Именно в этом заключаются ее буферные свойства. Даже в случае передозировки питьевой соды, рН воды не поднимается выше 8,4. Следует отметить, что значение рН = 9 практически не сказывается на самочувствии рыб и растений.
Добавление питьевой соды в мягкую и очень мягкую воду не дает стабильного результата. И если продолжать увеличение концентрации соды в воде, то уже повышенное содержание натрия в воде будет оказывать негативное воздействие на аквариумную флору.
Самым верным способом получения воды со стойкой щелочной реакцией является повышение ее жесткости не менее чем до 8°, после чего добавить в нее питьевую соду. Следует отметить, что если в аквариуме с жесткой водой, регулярно заменяется часть объема, то рН обычно больше 7.
Для придания воде буферных свойств достаточно добавлять питьевую соду в очень малых количествах. В такой воде наблюдаются лишь незначительные колебания рН в течение суток, а при ее старении значение pH не сдвигается в кислую сторону.
Как упоминалось выше, сверхмерное добавление соды может привести к избытку натрия в воде. На рыбах это никак не сказывается, а для растений может стать губительным.
Аквариумисты, занимающиеся «живородками», часто добавляют в воду обычную поваренную соль. Подсаливание воды для живородящих карпозубых совсем необязательно. Более правильным является увеличение жесткости воды, с одновременным добавлением небольшого количества питьевой соды.
Незначительное превышение натрия в воде можно компенсировать добавлением солей калия. Хороший результат получается при добавлении в воду поташа – углекислого калия (К2СО3). Соотношение ионов натрия и калия в воде 5:1 или 4:1 прекрасно переносится растениями и рыбами, но избыток калия губителен для рыб.
Поэтому вносить такие химические элементы, как натрий и калий, необходимые для жизнедеятельности организмов, необходимо очень осторожно.
Можно рекомендовать аквариумистам приготовить смесь питьевой соды и поташа в весовом соотношении 4:1 и добавлять ее в количестве от половины до целой чайной ложки на 10 литров заменяемой воды.
В зависимости от отношения к концентрациям водородных и гидроксильных ионов все гидробионты подразделяются на стеноионные (выдерживающие незначительные колебания) и эвриионные (способные переносить большие колебания).
В гидробиологической литературе к первым относят тех, которые выдерживают колебания до 5—6 единиц.
В аквариумной практике таких не так уж много, например, из растений — элодея, роголистник.
Криптокорины, апоногетоны выдерживают плавные и регулярные колебания в 1—2 единицы, такие же колебания допустимы для большинства рыб, а виды, подобные дискусу, еще более стеноионны.
Для обитателей аквариума существуют определенные, так называемые рН-барьеры, выход за пределы которых как влево по шкале (в кислую сторону), так и вправо (в щелочную) недопустим.
Недопустимо и перемещение обитателей аквариума из одной воды в другую при разнице их показателей рН больше чем на 0, 8—1, так как могут возникнуть шок у рыб, быстрое или постепенное разрушение тканей растений.
Что же происходит с гидробионтами, когда показатель рН приближается к цифрам барьера? Изменения уловить трудно, но знать о них необходимо.

У растений наблюдается явление, которое аквариумисты, не вдаваясь в его суть, назвали несовместимостью.
Однако практически несовместимых растений в наших аквариумах нет, а есть растения с разными рН-барьерами.
Например, кабомба при повышении рН до 8 останавливает фотосинтетическую деятельность, валлиснерия продолжает ее до 10, а элодея и до 11. Ясно, что «голодающая» кабомба сначала остановит рост верхушечных стеблей, а затем будет сбрасывать листья. Постепенно и у валлиснерии начнут разрушаться концы листьев возле поверхности, степень подщелачивания верхних слоев воды элодеей для этих двух видов окажется непереносимым ежедневным испытанием.
Более сложные растения потому и сложны в содержании, что у них нижний и верхний рН-барьеры незначительно отстоят друг от друга — ведь в текучих водах у них на родине нет таких скачков рН, какие происходят в аквариумах с неподвижной водой.
Снижение показателя рН воды повышает у рыб аппетит. Но радоваться этому не имеет смысла: аппетит вызван резким уменьшением усвояемости пищи, сокращением использования питательных веществ на рост, увеличением энергетических затрат.
Некоторые рыбы (например, барбусы) начинают чесаться о грунт и камни, дискогнаты теряют ориентировку и гибнут, ряд сомов погибают от дистрофии при активном потреблении корма. Ухудшается у рыб и захват кровью кислорода, частота дыхания увеличивается, но появляются признаки удушья.
Снижение показателя рН воды для многих тропических рыб служит стимулом к нересту — именно эти цифры и проставляют обычно для расбор, харацинид и других видов. Но держать их в подкисленной воде постоянно нецелесообразно, тем более выращивать молодь.
Наиболее подходящая вода для большинства обитателей аквариума должна иметь колебания рН около 7.
Это достигается главным образом правильным уходом за аквариумом, регулярной сменой части воды, постоянным принудительным движением ее, чистотой водоема.
Как определить величину pH?
Сегодня многими производителями выпускаются электронные приборы для измерения рН, называемые рН-метрами. Пользоваться ими не просто и стоимость таких приборов высока, кроме того pH-метры требуют периодической поверки в специальном сервисном центре.

Аквариумисту, для измерения рН, проще применять так называемый колориметрический метод, основанный на свойствах некоторых красителей (индикаторов) изменять свой цвет при различной величине рН. В настоящее время в продаже есть множество наборов позволяющих измерять не только pH воды, но и многие другие параметры. В отличие от электронных приборов, колориметрические средства измерения имеют вполне доступную цену.
В последнее время в продаже появились портативные pH-метры, доступные по цене, предназначенные для измерения активной реакции воды в аквариумах, бассейнах и т.д., и специально разработанные для измерений, к которым предъявляется высокая точность.
Пользоваться таким прибором очень просто, для получения более точного результата следует проводить несколько этапов измерений.
За окончательный результат берется среднее значение. Прибор откалиброван.

Особенности портативного pH-метра:
- Диапазон измерения pH: 0 -14
- Встроенный сенсор для автоматической компенсации температуры ATC (от 0° до 50°C)
- Рабочая температура (от 0° до 50°C)
- Цена деления 0.1pH
- Погрешность +/- 0.1 pH
- Калибровка с помощью калибровочной отвертки (в комплекте)
- Питание: батареи 3 х 1.5 V (AG-13 ) в комплекте
- Размеры: 15.2 х 2,8 х 1,5 см
- Вес: 50 гр
Порядок работы с прибором:
- Снимите защитный колпачок.
- Опустите электрод прибора в дистиллированную воду, затем достаньте и осторожно обмокните электрод в фильтровальную вату.
- Включите прибор нажав кнопку ON.
- Опустите электрод в среду для измерений и слегка поболтайте.
- Дождитесь, пока показания прибора стабилизируются.
- После измерений для увеличения срока службы прибора, очистите электрод.
- Установите защитный колпачок.





